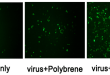
首先siRNA由于只 …
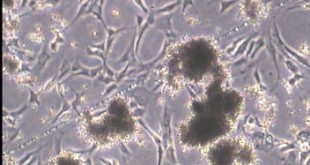
阅读更多 »做嘌呤霉素筛选滴定时,感染两天,puro杀3天,5天细胞长得很密原因和解决方法,另外镜下数整个孔的克隆数感觉困难,能换成镜下视野面积与孔面积比换算吗?
问题1:“感染两天,puro杀3天,5天细胞都长很密” 原因: 细胞分裂快(比如 293T)→ 在5天内即使有筛选,还是会长满。 感染率高 → 很多细胞表达抗性,嘌呤霉素筛选不够“稀释” 建议: 缩短时间:感染 24h 后就加 puromycin,第 2 天开始杀,杀 2–3 天就足够。 更稀释的病毒梯度:推荐加大稀释倍数:1:1000,1:5000,甚至 …
阅读更多 » 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享