本人读研期间,我们实验室的核心项目是某大型传染性疾病的研究,核心技术是基因敲除。进实验室的师兄师姐师弟师妹,人手一个基因敲除,有的甚至两三个一起敲,还有共敲除(反正就是变着花样的敲就对啦)
我也不例外,除了我的课题还有其他任务外,外加一个基因敲除。不要说导师把我们当牲口使,谁让我们的毕业大事掌握在他手里呢。
其实基因敲除是个不简单的工作,对当时的我来说。就从最基础的PCR就把我难住了。基因敲除就是要不停地进行PCR。PCR是其中一大项,还有一个值得关注的点就是酶切了。可不要小看了酶切这一步。从酶切位点的选择,引物设计,酶切的工作做就已经开始了。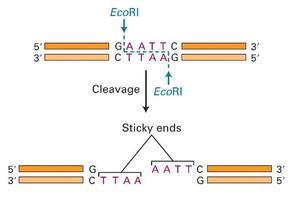
我们的基因敲除是利用同源重组的方法将目的片段置换敲除,所以引物设计的时候就在目的片段两端进行设计,实在找不到合适的就直接把目的片段两端的那十几二十个碱基拿来做引物吧。然后加上不同的酶切位点。选择酶切位点的时候一定要用软件把你的目的序列放进去分析一下,你的目的片段里都有哪些酶切位点。一定不要选择你的目的片段里有的酶切位点,否则你酶切的结果是很多的小片段,而不是你的目的片段。
在设计一个酶位点时,最好把该酶的性质弄清楚设计时限制性酶切位点是应该在5’端的顶端。在设计引物时,常在5‘端添加酶切位点,以利于PCR产物连接到载体。
两个酶切位点应是载体上的,所连接片断上没有这两个位点,且距离不能太近,往往导致两个酶都切不好。因此,紧挨在一起,只能切一个,除非恰好是与上面两个酶在一起的酶切位点。最好隔四个。还有一种情况是:不能有碱基的交叉,比如AGATCTTAAG,这样的位点比较难切。
两个酶切点最好不要是同尾酶(切下来的残基不要互补),否则效果相当于单酶切。
最好使用酶切效率高的。 最好使用双酶切有共同buffer的酶。实验室较常用的酶(如hind3,bamh1,ecor1等),最好使用自己实验室有的酶,这样可以省钱。
酶切位点都需要保护碱基以利于内切酶的有效切割。酶切位点前加保护碱基1,两个酶切点至少隔上3个碱基,在做载体构建的时候设计引物扩增片段进行定向连接,除了酶切位点,还要在两端加一个
三个核苷酸的保护序列,否则PCR产物很难被酶切。
所以引物顺序应是:5’—保护碱基+酶切位点+引物配对区—3’
还有一点要提醒大家的就是酶切位点的顺序,一定不要放反了。我有个小师妹就是置换基因和目的基因虽然用的是同样的两种酶,但是她把酶的方向搞反了,结果怎么连序列都是反的。希望大家注意,一定不要搞反了哦。
酶切引物搞好了,后面的工作就是简单的PCR,酶切,连接了,现在一般都有试剂盒,一般生物公司都有这些相关试剂,现在的产品质量也参差不齐,一些大公司的产品质量不错,就是价钱贵了点。国内的一些小企业的产品性价比还不错,一般的实验需求都能达到,关键是省钱(因为可能会重复个几次,几十次,尤其是筛选的时候)
祝君实验顺利,一切安好。
 英格恩生物技术博客 生物实验干货分享
英格恩生物技术博客 生物实验干货分享

方便联系吗 我是研一的学生 想要学习基因敲除的知识 做这个方面的实验 可以交流一下吗
可以扫码或者搜索“英格恩”关注公众号哦~